Adatszolgáltató
Budapesti Műszaki és Gazdaságtudományi Tanszék, Alkalmazott Biotechnológia és Élelmiszertudományi Tanszék, Környezeti Mikrobiológia és Biotechnológia Kutatócsoport
Elérhetőség
A módszer fő adatlapja
Módszerre vonatkozó információk
Mért végpont
A módszer méréstechnikai jellemzése
Mérési tartomány
- Fémek, félfémek és vegyületeik
Mérési tartomány
- Kőolajszármazékok (TPH)
Mérési tartomány
- Halogénezett alifás szerves vegyületek
Mérési tartomány
- Egyéb szerves vegyi anyag
Kivitelezés feltételei
Kivitelezés költségei
A módszer részletes ismertetése
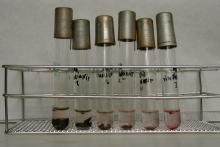
A teljes talaj használata a kivonat helyett közvetlen érintkeztetést biztosít a tesztorganizmussal. A toxikus anyag által gátolt légzést a dehidrogenáz enzim aktivitásán keresztül mérjük. A dehidrogenáz aktivitását egy alternatív elektronakceptor, a tesztelegyhez tett TTC színváltozása jelzi. A színváltozást az okozza,hogy a TTC-ből formazán keletkezik. Ezt a piros színt vagy a talajszuszpenzióban vizuálisan állapítjuk meg (igen-nem), vagy oldószeres extrakció után fotométerrel mérjük.
Ismeretlen talajszennyezőanyagokkal és keverékekkel szennyeztt talaj esetén. Ha a szennyezőanyag hozzáférhetősége korlátozott és várható az idő és a körülmények függvényében megváltozhat. Ha fontos, hogy a tesztelés folyamán a tesztmikroorganizmusok érintkezzenek a tesztelendő talajjal vagy más meghatározó kölcsönhatások megnyilvánuljanak.
A talajszuszpenzió jelenléte ronthatja a vizuális kiértékelés jóságát.
Az Azomonas agilis-t ferde Fjodorov tápagaron tartjuk fenn. Átoltás után 48 órán át 28 ºC-on inkubáljuk.
A teszthez 30 ml steril Fjodorov táptalajba, Azomonas agilis-t oltunk be, az inokulumot 72 órán át 28 ºC-on rázógépen rázatjuk.
A vizsgálandó mintákból 2-2 g talajt egy órán keresztül, áramló gőzben sterilezzük. A talajmintákból a méréshez öttagú, kétszeres léptékű hígítási sort készítünk: 0,5 g, 0,25 g, 0,125 g, 0,0625 g és 0,0312 g, kémcsőbe bemért mennyiségekkel. A bemérést steril körülmények között végezzük. Idegen mikroorganizmusok gátolhatják az Azomonas agilis szaporodását.
A 48 órán keresztül, 25 oC-on rázatott baktériumszuszpenzióból 5 cm3-hez 100 cm3 steril Fjodorov táptalajt és 1 cm3 steril TTC oldatot adunk. Az elkészített keverékből a talajokat tartalmazó kémcsövekbe 2-2 cm3-t pipettázunk, homogenizáljuk (Vortex segítségével), 72 órán át 28 ºC-on sötétben inkubáljuk.
Referenciaként 400, 40, 4, 0,4 és 0,04 ppm koncentrációjú Cu- hígítási sorozatot használtunk. Az értékelést 72 óra múlva végeztük, vizuális módon. A piros szín megjelenése mikrobiális tevékenységre utal. Toxikus anyagok jelenlétében a dehidrogenáz enzimaktivitás gátolt, a TTC redukciója nem történik meg, a piros szín nem jelenik meg, vagy intenzitása kisebb, mint a szennyezetlen kontrollé. Ahol a piros szín nem jelenik meg, az enzimaktivitás gátlás 100%, 50%-os gátlás esetében halvány piros szín látható. A piros szín megjelenése mikrobiális tevékenységre utal (nincs gátlás).
A bemért talajmennyiségek függvényében ábrázoljuk a gátlás-értékeket. A kapott dózis-válasz görbéről leolvassuk az 50% enzimaktivitás-gátláshoz tartozó szennyezett talajdózis-értékeket(ED50), ami azt jelenti, hogy hány gramm talaj csökkenti az enzimaktivitást a felére.
SWOT (értékelés osztályzattal)
SWOT (szöveges értékelés)
Ez a tesztorganizmus és a direkt kontaktust biztosító teszt a toxikus fémek mellett, a nehezen hozzáférhető szennyezőanyagokra is érzékeny, mint például PAH-ok, PCB-k.
Talajlakó tesztorganizmusról lévén szó, reális választ kaphatunk a segítségével a talajökosztisztémára gyakorolt hatásról.
A tesztorganizmus érzékenységét kontrollálni kell. A végpont, a piros anyagcseretermék észlelése szubjektív lehet, barnás színű, sötétebb és a vizes szuszpenzióban nem ülepedő talajoknál nehezebb értékelni.
A teszt értékelése nem csak vizuálisan történhet, a keletkezett anyagcsereterméket, mely a piros színt okozza, szerves oldósezrrel ki is extrahálhatjuk, és fotometrálhatjuk, így az eredmény objektívebb,és kvantitatív.
A mintát sterilezni kell, a sterilezés hatására végbemenő fizikai-kémiai hatásokra gondolnunk kell (párolgás, bomlás, új toxikus bomlástermék), és annak megfelelően kell megválasztanunk a talajminta sterilezésének módját.
Egyéb információk, referenciák
A talajszuszpenzióval végzett teszt eredménye nagy Kow értékű szenyezőanyagok esetében és szinergista hatások esetén nagyobb toxicitást mutat, mint ugyanazon talaj vizes extraktumával végzettteszt. Így ez a teszt a vizes kivonathoz képet konzervatívabb eredményt ad, de egy reális határon belül. Egyes szennyezőayag-talaj kölcsönhatások olyan erősek lehetnek, hogy szuszpenziós tesztben a talaj mátrixhatása miatt kisebb hatást mérünk, mint egy vizes kivontaban vagy csurgalékban. A két eredmény összhasonlítása a talaj toxicitást pufferoló képességére ad felvilágosítást.
Gruiz, Horváth és Molnár (2001)Környezettoxikológia – Vegyi anyagok hatása az ökoszisztémára, Műegy.Kiadó, Bp.
Gruiz, K. (2005) Soil testing triad for contaminated soil – In: Soil Remediation No6. (Eds.Fava and Canepa) pp.45–70, INCA, It
Feigl, V., Atkári, Á., Anton, A., Gruiz, K. (2007) Chemical stabilisation combined with phytostabilisation, Adv. Mat. Res. 20–21, 315–318.
Feigl V., Atkári Á., Uzinger N., Gruiz K. (2006) Fémmel szennyezett területek integrált kémiai és fitostabilizációja, Orsz. Körny.véd. Konf. Kiadványa 99–108.
Konkrét megvalósult alkalmazások
Fitoremediációs technológia követésére jól alkalmazahtó teszt, jól követhető az alkalmazott adalékanyagok toxikusfém-stabilizációs hatása.